(UroToday.com) Presentación del Dr. Evan Goldfisher sobre la sesión sobre cáncer de próstata y la eficacia y seguridad por volumen y riesgo de la enfermedad en el ensayo de fase 3 ARASENS en la Reunión Anual de la Sección Sudeste de 2024 de la AUA (SESAUA). En pacientes con cáncer de próstata metastásico sensible a hormonas (mHSPC), la carga de enfermedad metastásica es un factor pronóstico. Darolutamida + ADT + docetaxel redujeron el riesgo de muerte en un 32,5% (HR 0,68; IC 95%: 0,57–0,80; pag <0,0001) placebo + ADT + docetaxel en pacientes con mHSPC en el ensayo ARASENS.1 Los resultados basados en el tamaño y el riesgo de la enfermedad brindan información adicional a los médicos al tomar decisiones sobre la intensidad del tratamiento para pacientes con mHSPC. En la reunión anual de SESAUA de 2024, el Dr. Goldfisher y sus colegas estratificaron los resultados de los pacientes en subgrupos de alto/bajo volumen de enfermedad y alto/bajo riesgo.
Los pacientes con mHSPC fueron aleatorizados 1:1 a darolutamida 600 mg dos veces al día o placebo, ADT + docetaxel:
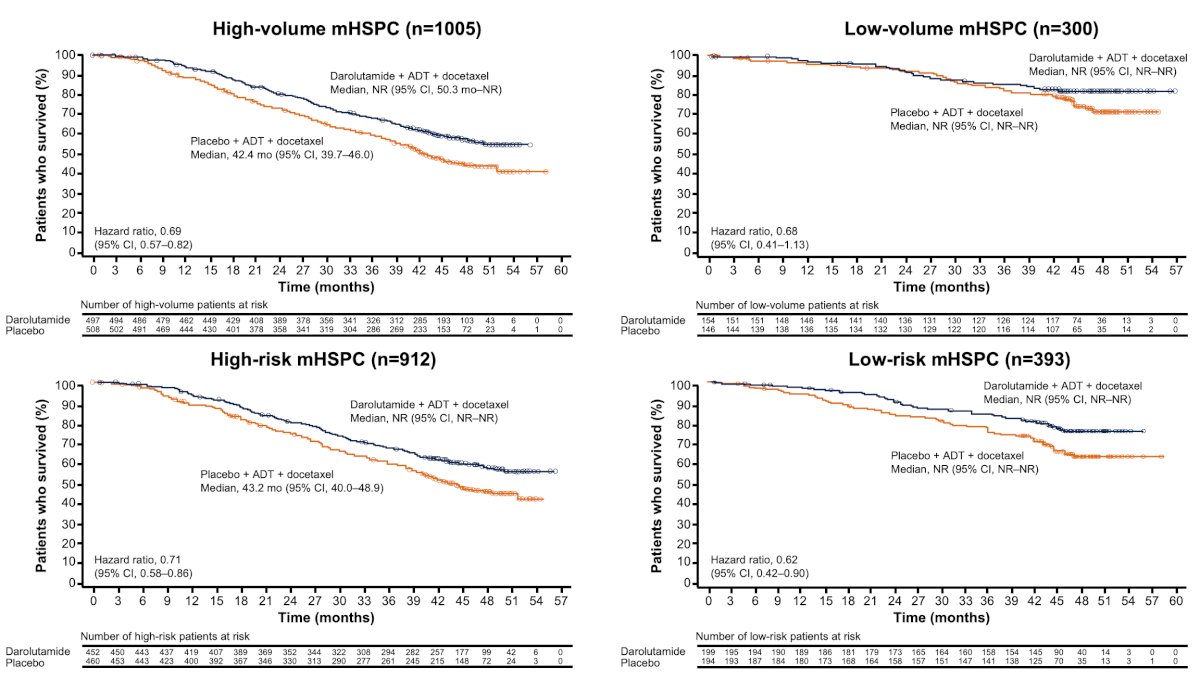
La enfermedad de alto volumen se definió como pacientes con ≥1 metástasis viscerales y/o ≥4 metástasis óseas más allá de la columna vertebral/pelvis (criterios CHAARTED). La enfermedad de alto riesgo se definió como pacientes con ≥2 factores de riesgo: puntuación de Gleason ≥8, ≥3 lesiones óseas y presencia de metástasis viscerales mensurables (criterios LATITUDE). La supervivencia global de estos subgrupos se estimó mediante un modelo de regresión de Cox no estratificado.
De los 1305 pacientes, 1005 (77%) tenían enfermedad de alto volumen, 912 (70%) tenían enfermedad de alto riesgo, 300 (23%) tenían enfermedad de bajo volumen y 393 (30%) tenían enfermedad de bajo riesgo. Darolutamida + ADT + docetaxel mejoró la supervivencia general con HR de 0,69 y 0,68, respectivamente, y placebo + docetaxel + ADT, independientemente de si la enfermedad era de alto o bajo volumen. Se observó un beneficio de supervivencia general similar para darolutamida + ADT + docetaxel versus placebo en pacientes con enfermedad de alto o bajo riesgo:
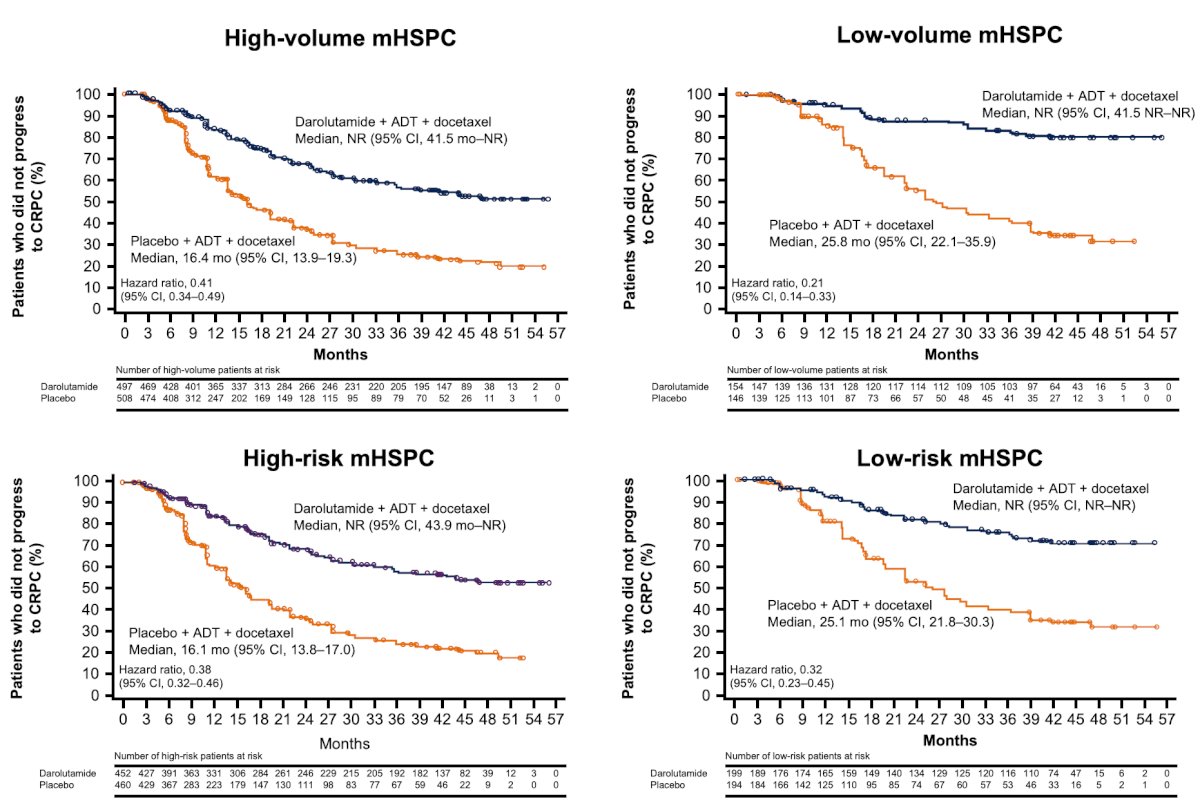
La darolutamida mejoró el placebo en los subgrupos de alto/bajo volumen y de riesgo frente a criterios de valoración secundarios clínicamente relevantes, incluido el tiempo hasta el CRPC, con HR generalmente en el rango de los observados en la población general:
La incidencia de eventos adversos emergentes del tratamiento fue consistente con la población general de ARASENS en subgrupos por volumen alto/bajo y riesgo alto/bajo.
El Dr. Goldfisher concluyó su presentación analizando la eficacia y seguridad por volumen y riesgo de enfermedad en el ensayo de fase 3 ARASENS con las siguientes conclusiones:
- La combinación de darolutamida + ADT y docetaxel mejoró la supervivencia general, con una reducción de ~30 % en el tamaño de la enfermedad y el riesgo de muerte en todos los subgrupos de riesgo.
- La mediana de supervivencia general no se alcanzó en el grupo de darolutamida independientemente del tamaño o riesgo de la enfermedad.
- Se confirmó un perfil de seguridad favorable de darolutamida en todas las poblaciones de subgrupos de riesgo y volumen, consistente con la supervivencia general en la población ARASENS.
Presentado por: Evan Goldfisher, MD, MBA, FACS, Premier Medical Group, Poughkeepsie, Nueva York
Escrito por: Zachary Klaassen, MD, MSc – Oncólogo Urológico, Profesor Asociado de Urología, Georgia Cancer Center, WellStar MCG Health, @zklaassen_md en Twitter durante la Sección Sureste de 2024 de la Asociación Estadounidense de Urología (SESAUA, Annual Mean TingX) miércoles, marzo 20 – Sábado 23 de marzo de 2024.
Referencias:
- Smith MR, Hussain M, Saad F, et al. Darolutamida y supervivencia en el cáncer de próstata metastásico sensible a hormonas. N Engl J Med. 24 de marzo de 2022;386(12):1132-1142.

«Orgulloso pionero de Twitter. Analista. Comunicador. Geek web profesional. Especialista en música de por vida».